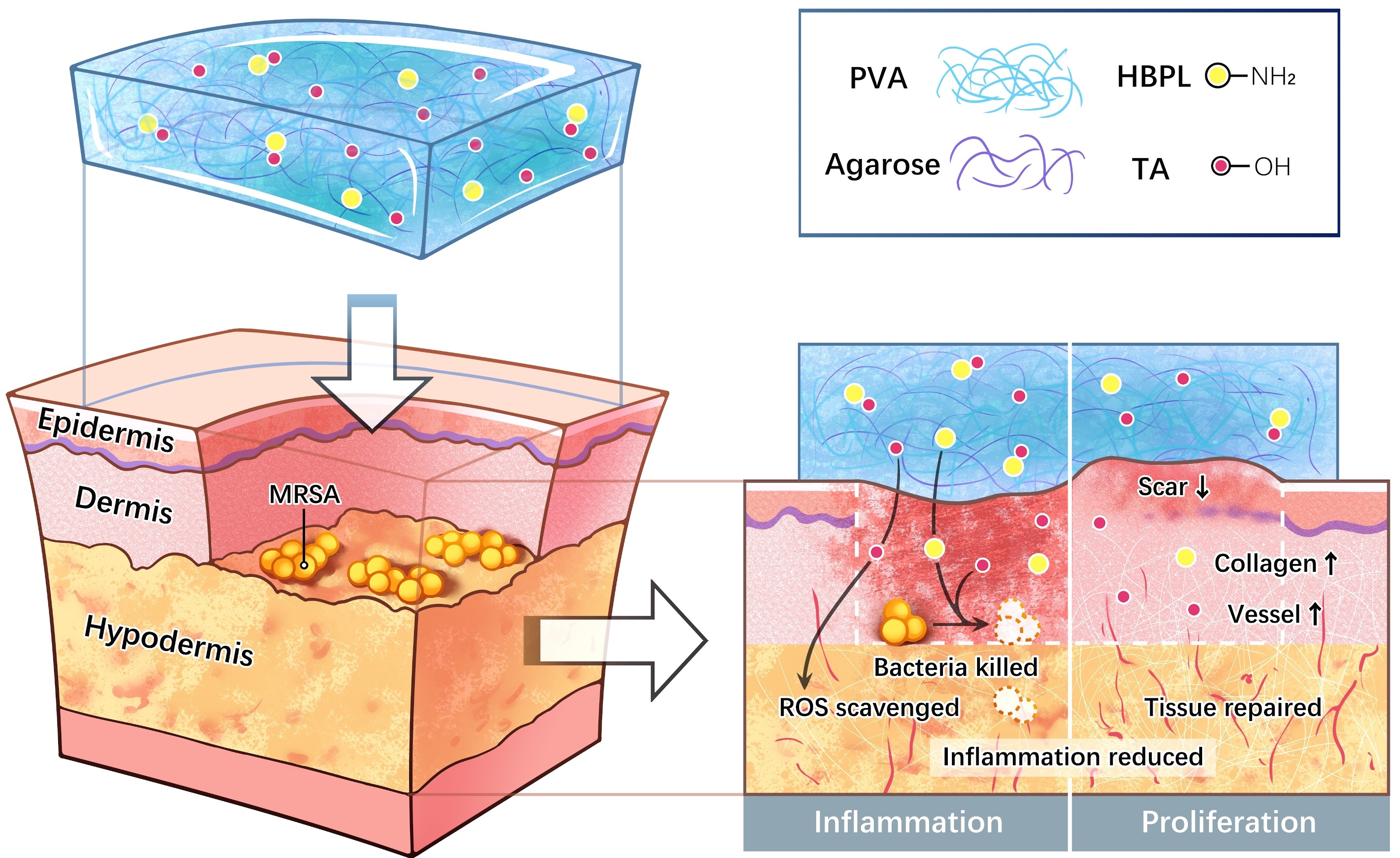
浙江大学高长有教授、叶娟教授团队合作Bioactive Materials:A tough, antibacterial and antioxidant hydrogel dressing accelerates wound healing and suppresses hypertrophic scar formation in infected wounds
2024-12-16增生性瘢痕(HSs)通常出现在深部皮肤损伤后,给患者的生活造成了极大的不便。HSs的产生和发展与伤口愈合过程密切相关,当炎症阶段持续或伤口愈合延迟时,就会导致HSs等病理性瘢痕的出现。本质上讲,HSs是网状真皮的炎症性疾病,其特征是炎症反应延长、血管生成过度以及肌成纤维细胞和胶原蛋白的过度积累。细菌感染和氧化应激是导致炎症的两个典型因素。目前针对HSs的敷料研究往往忽视了细菌感染的潜在影响。考虑到细菌感染的多发性和广泛性,有必要明确感染情况下HSs的预防和治疗。近期,浙江大学高分子系高长有教授团队和浙江大学医学院附属第二医院叶娟教授团队联合设计了一种强韧水凝胶敷料,以促进感染伤口的愈合并控制瘢痕的形成。水凝胶基质由聚乙烯醇(PVA)和琼脂糖的双网络结构构成,为水凝胶的力学性能提供强力支撑,并负载超支化聚赖氨酸(HBPL)和单宁酸(TA)赋予水凝胶具备抗菌和抗氧化能力(图1)。图1 抗菌和抗氧化水凝胶敷料加速感染伤口愈合、减少增生性瘢痕的形成。 一、水凝胶的制备与表征制备了五种类型的水凝胶敷料(表1)。以PAHT水凝胶为例,制备方法如下:在110 ℃下,机械搅拌下将20 wt% PVA1799和2 wt%琼脂糖溶解在76.2 wt%水中;冷却至90 ℃后,加入1 wt% HBPL(博慧(浙江)生物技术有限责任公司)和0.8 wt% TA,调节pH至6;完全溶解后,将溶液浇铸到模具中,并冷却至室温,然后将其在-20 ℃下冷冻4小时,并在室温下解冻1小时,此过程重复3次。其他水凝胶按照类似的过程制备。表1 本研究制得的各水凝胶简称及组成 合格的水凝胶敷料应具有足够强韧的力学性能。与单网络PVA水凝胶相比,所有双网络水凝胶的抗拉性均有显著提高。HBPL的添加实现了较大程度的增强,而TA的效果较小。当HBPL和TA同时存在时,拉伸模量最大,而断裂伸长率和断裂强度略有下降,表明它们的增强效果似乎具有拮抗作用(图2A-E)。在压缩测试中,所有水凝胶都没有破碎,只产生了少量的塑性变形;所有双网络水凝胶的抗压性均高于单网络水凝胶(图2F-H)。PAHT水凝胶具有良好的耐疲劳性能,在20次循环拉伸和压缩测试中未观察到明显的塑性变形,滞后环小(图2I, J)。这些结果证明,双网络水凝胶PAHT表现出良好的力学性能,在应用中不会破裂或失效。图2 水凝胶的机械性能。(A)不同组分水凝胶的拉伸应力-应变曲线。(B)PAHT水凝胶拉伸试验照片。(C)不同水凝胶的拉伸模量、(D)断裂伸长率和(E)断裂强度。(F)不同组分水凝胶的压缩应力-应变曲线。(G)PAHT水凝胶压缩试验照片。(H)不同水凝胶的压缩模量。PAHT水凝胶的循环拉伸(I)和压缩(J)曲线。 水凝胶敷料通常设计用于吸收伤口环境中的渗出物。然而,过度吸水会导致水凝胶体积的极度膨胀和力学性能的急剧下降,不利于其对伤口的持续保护。PAHT水凝胶具有良好的抗溶胀性,且溶胀平衡后仍然保留足够大的力学性能(图3A, B)。另一方面,水凝胶敷料可以为伤口愈合提供有利的湿环境。当未施加保护膜时,PAHT水凝胶所含的水分快速流失(图3C)。然而,在实际应用中,伤口敷料通常覆盖有一层保护膜,可以抵抗污染并保持水分。因此失水率将大大降低,不会影响水凝胶应用。水凝胶中的功能组分HBPL和TA是通过物理作用负载的,可以在伤口环境中释放。当HBPL和TA单独存在时,可实现快速释放;当HBPL和TA共存时,由于二者之间的静电相互作用以及TA与水凝胶基质分子间的氢键作用,释放速率减缓(图3D, E)。值得一提的是,在体内应用中,由于液体量更少,HBPL和TA的释放速度要慢得多,因此预计功能性会更持久。图3 水凝胶的理化和生物学性质。(A)PAHT水凝胶的溶胀能力和(B)溶胀后的拉伸性能。(C)PAHT水凝胶的保湿能力。(D)HBPL和(E)TA的累积释放。水凝胶对(F)DPPH、(G)·OH、(H)·O2−和(I)H2O2的清除效果。与水凝胶孵育后(J)MRSA和大肠杆菌菌落的照片,以及(K,L)相应抗菌率的定量计算。水凝胶的(M)细胞和(N)血液相容性。 二、水凝胶的抗氧化能力、抗菌能力和生物相容性减轻伤口的氧化应激对于减少随后的瘢痕形成至关重要。由于TA优异的抗氧化能力,含有TA的PAT和PAHT水凝胶对DPPH、·OH、·O2−和H2O2具有高效的清除效果,HBPL中氨基的还原性也贡献了部分抗氧化能力(图3F-I)。细菌感染是伤口炎症的重要原因,阻碍伤口愈合并加重瘢痕形成。分别以MRSA和大肠杆菌作为革兰氏阳性菌和革兰氏阴性菌为代表进行测试。PA水凝胶没有抗菌效果,由于TA的存在PAT水凝胶具有一定抗菌能力,而加入HBPL的PAH和PAHT水凝胶可以杀死几乎所有细菌(图3J-L),表明HBPL的高效抗菌性能。HBPL的抗菌性主要来源于其丰富的氨基通过静电作用对细菌细胞膜的破坏。伤口敷料必须安全无害。因此,分析了水凝胶的细胞相容性和血液相容性,均呈现出良好的安全性(图3M, N)。 三、水凝胶促进感染伤口愈合的效果为评价PAHT水凝胶敷料治疗体内创面的效果,建立了MRSA感染的全层皮肤缺损大鼠模型(图4A)。含HBPL的水凝胶抗感染能力十分突出,PAHT组愈合最快,12天时伤口几乎完全闭合(图4B-D)。从收集的伤口组织中分离出细菌,分析各组的体内抗感染能力。与宏观观察结果一致,对照组和PA组的伤口中存在大量细菌,PAT组的细菌数量减少,而PAH和PAHT组的细菌含量最低(图4E, F)。图4 水凝胶促进MRSA感染的伤口愈合效果。(A)伤口愈合实验方案。(B)不同时期用不同水凝胶治疗的感染伤口的代表性图像。(C)伤口愈合过程动态图,以及(D)伤口面积的定量分析。(E)不同水凝胶治疗后伤口中MRSA含量的定量计算,以及(F)相应的菌落照片。 ELISA结果显示,促炎因子TNF-α、IL-1β和IL-6的表达在所有治疗组中均下调,其中抗菌和抗氧化功能最强的PAHT组下调最为显著(图5A–C)。相应地,抗炎因子IL-4和IL-10在所有治疗组中均上调,尤其是PAHT组(图5D, E)。这些结果表明PAHT水凝胶在体内抗炎方面具有显著的功效。通过病理染色对伤口愈合进行更详细的分析标明,在整个愈合过程中,PAHT组的炎症浸润最轻,组织再生和胶原沉积最好(图5F)。众所周知,血管生成在伤口愈合中起着重要作用,而CD31可以代表新血管的形成。免疫组化染色和相应的定量分析结果表明,PAHT水凝胶治疗显著提高了CD31的表达(图5G, H)。这些结果表明,抗菌和抗氧化敷料在加速伤口闭合和表皮再生、促进胶原沉积和血管生成方面具有很强的积极作用,从而为皮肤伤口恢复提供了有力的支持。图5 大鼠伤口组织的ELISA和组织学分析。伤口中(A)TNF-α、(B)IL-1β、(C)IL-6、(D)IL-4和(E)IL-10炎症因子的表达水平。(F)伤口愈合过程中的H&E和Masson染色。(G)第12天伤口组织的CD31免疫组织化学染色,以及(H)定量分析。 四、水凝胶抑制增生性瘢痕形成的效果建立了兔耳增生性瘢痕模型(图6A)。前4周的创面愈合阶段与大鼠模型结果基本一致。在第4周结束时,在对照、PA和PAT组中观察到明显的红色瘢痕。之后,瘢痕逐渐稳定,随着时间的延长颜色逐渐减退。在所有组中,PAH组和PAHT组的瘢痕外观最接近正常皮肤(图6B)。图6 水凝胶抑制MRSA感染伤口的增生性瘢痕形成的效果。(A)增生性瘢痕实验方案。(B)在不同时期用不同水凝胶治疗的伤口闭合和随后的瘢痕形成和稳定的代表性图像。 H&E染色(图7A)显示随着水凝胶功能的增多,HSs厚度逐渐减小,瘢痕抬高指数(SEI)显示出相同的趋势(图7B, C)。HSs的形成与胶原蛋白的过度沉积密切相关。Masson染色计算的胶原体积分数(CVF)表明,经水凝胶治疗后,胶原蛋白的过度沉积受到明显抑制(图7D)。胶原纤维的类型对皮肤形态至关重要,通过偏振光显微镜观察天亮星红染色样品,发现对照组中几乎没有III型胶原蛋白;用功能性水凝胶治疗后,III型胶原蛋白的比例增加。此外,肌成纤维细胞的过度活动会导致HSs形成和进一步的挛缩。α-平滑肌肌动蛋白(α-SMA)作为成纤维细胞转化为肌成纤维细胞的标志物,在HSs中特异性过表达。免疫荧光染色显示对照组中α-SMA表达尤为明显;随着水凝胶功能的增多,α-SMA的表达逐渐降低,PAHT组的状态最接近正常皮肤。总之,PAHT水凝胶可发挥显著抑制HSs生成的作用。图7 兔耳瘢痕组织的组织学分析。(A)各组的H&E染色、Masson染色、天狼星红染色(偏振光显微镜观察)和α-SMA免疫荧光染色。H&E染色中(B)瘢痕厚度和(C)瘢痕抬高指数(SEI)以及Masson染色中(D)胶原体积分数(CVF)的定量分析。 进行RNA测序探讨PAHT水凝胶加速感染伤口愈合和抑制HSs生成的潜在机制。正常组、对照组和PAHT三组的主成分分析显示转录组谱存在显著差异(图8A)。火山图显示出对照组与正常组、PAHT和对照组的差异基因数量(图8B, C)。基因热图显示,与正常组相比,与免疫和炎症反应相关的基因在对照组中显著上调;经PAHT水凝胶治疗后,这些基因的表达恢复到接近正常组的水平(图8D)。对对照组与正常组上调、PAHT和对照组下调的基因取交集,并利用KEGG分析潜在的信号通路,发现差异基因显著参与与宿主防御、免疫调节和炎症通路相关的信号通路(图8E)。综上,PAHT水凝胶促进伤口修复并减少HSs形成的机理是减少感染和控制炎症。图8 PAHT水凝胶抑制增生性瘢痕形成的机理分析。(A)正常组、对照组和PAHT三组的主成分分析。(B)对照组与正常组和(C)PAHT与对照组的差异基因火山图。(D)差异基因热图。(E)对照组与正常组中上调、PAHT与对照组中下调交集基因的KEGG通路分析。 五、总结通过PVA和琼脂糖构建双网络结构,加入HBPL和TA制备了PAHT水凝胶,具有抗菌、抗氧化功能,能够促进伤口愈合并抑制后续HSs生成。水凝胶的制备工艺简单易重复,相关原料安全、价格低廉、应用广泛。通过力学实验验证了其优异的强度、韧性和抗疲劳性能,证明了双网络结构的有效性。该水凝胶能够快速去除ROS,并对革兰氏阳性菌和革兰氏阴性菌均表现出有效的杀灭能力。在大鼠伤口模型中,PAHT水凝胶显示出促进伤口愈合、杀死体内细菌、减少炎症和促进组织再生的能力。在兔耳瘢痕模型中,PAHT水凝胶对抑制HSs形成有显著影响。具体而言,PAHT水凝胶能够减少瘢痕厚度,减少胶原沉积,调节胶原纤维类型并下调α-SMA的产生。RNA测序表明,PAHT水凝胶的良好效果主要源于其有效抵抗MRSA从而缓解炎症反应的能力。综上所述,PAHT水凝胶具有广阔的转化前景,将在感染创面的抗瘢痕形成领域发挥关键作用。 该工作以“A tough, antibacterial and antioxidant hydrogel dressing accelerates wound healing and suppresses hypertrophic scar formation in infected wounds”为题发表在Bioactive Materials期刊上,共同第一作者为浙江大学高分子系在读博士研究生刘笑庆和浙江大学医学院在读博士研究生孙一鸣,共同通讯作者为浙江大学高分子系高长有教授和浙江大学医学院附属第二医院叶娟教授。该工作受到了山西-浙大先进材料与化学工程研究院、浙江省自然科学基金、国家自然科学基金和浙江省领雁计划的资助。